本人是北京市某小学生家长。2022年2月上旬开始,本人从子女所就读的学校以及北京其他学校家长处得知,北京市教委将在2022年春季开学时实施一项变相强制要求学生接种新冠疫苗的安排,其大致内容是:除医生出具不能接种新冠疫苗证明的以外,所有学生必须接种新冠疫苗;若不接种新冠疫苗,学生必须每48小时进行一次新冠检测,每次到校时必须出示48小时内新冠检测结果,否则不能入校上学。
虽然该安排尚未见正式发文,但已通过多所学校传达。若实施该安排,无疑会对所有暂不打算为子女接种现有新冠疫苗的家长和其子女带来重大影响。本人坚决反对该项政策。本人撰写本文,希望北京市教委,北京市防疫主管机关充分考虑该项政策的合法性、合理性、适当性。
一、目前国家批准的多款新冠疫苗,均属于特殊的“附条件批准”疫苗,批准在18岁以上使用。所述疫苗在3-17岁范围使用,属于未经上市批准的“紧急使用”范畴。无论“附条件批准”还是“紧急使用”均表明相应疫苗具有一定的风险或未获得充分的临床试验论证。政府主管部门有责任依法对所述疫苗的接种采取“安全第一”的方针。学生家长对所述具有较高风险的疫苗选择不接种,具有极强的合理性。
(一)疫苗针对18岁以上的“附条件批准”上市情况及其风险。
目前,在小学推广接种的疫苗包括“国药北京生物疫苗”、“科兴疫苗”、“国药武汉生物疫苗”,相关疫苗针对18岁以上人群上市注册附条件批准情况如下:
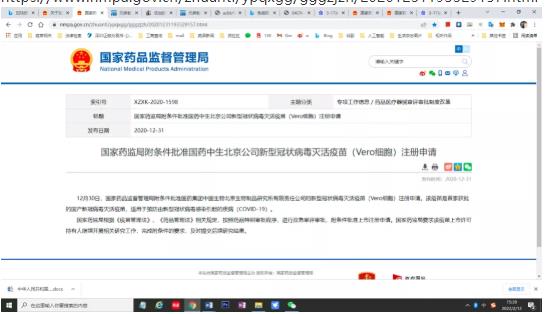
2020年12月30日国家药品监督管理附条件批准国药集团中国生物北京生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。
2021年2月5日国家药品监督管理附条件批准北京科兴中维生物技术有限公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。
2021年2月25日,国家药品监督管理局附条件批准国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。
上述疫苗的批准文件中均称:“国家药监局根据《疫苗管理法》《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准上市注册申请。国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果。”
第一,上述附条件批准疫苗具有高于一般疫苗的风险。
对于上述批准文件中“附条件批准”的性质,《疫苗管理法》有相应规定。
该法第十九条规定的是一般批准的情形,即“第十九条在中国境内上市的疫苗应当经国务院药品监督管理部门批准,取得药品注册证书;”
该法第二十条一款规定的是“附条件批准”的情形,即“第二十条 应对重大突发公共卫生事件急需的疫苗或者国务院卫生健康主管部门认定急需的其他疫苗,经评估获益大于风险的,国务院药品监督管理部门可以附条件批准疫苗注册申请。”
在上述十九条规定的一般批准的疫苗规定中没有提及风险问题,而第二十条附条件批准疫苗提及了风险问题,故附条件批准疫苗的风险不同于一般情况下批准的疫苗的风险,是具有一定风险,但因急需,经评估“获益大于风险”的疫苗。因此,从国家法规可知,“附条件批准”的疫苗较一般批准的疫苗具有较高的风险。
第二,上述疫苗批准时未完成全部研究工作,未获得全部研究结果。
上述批准文件中描述“继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果”,说明附条件批准的相关新冠疫苗,其研究工作并没有完成,尚未获得完整的研究结果,对疫苗的情况尚未完全掌握,具有一定尚未知晓的风险。而目前笔者并未发现国家机关有官方文件描述后续研究情况。
第三,上述疫苗对3-17岁人群的使用未获得上市批准。
笔者于上述疫苗厂商官方网站查询上述疫苗的“说明书”,其疫苗接种对象均描述“本品适用于18岁及以上人群的预防接种”。国家对于上市疫苗的说明书,有严格的审核备案规定。《疫苗管理法》规定:“第二十一条”国务院药品监督管理部门在批准疫苗注册申请时,对疫苗的生产工艺、质量控制标准和说明书、标签予以核准。”因此,所述疫苗对3-17岁人群的使用并未获得《疫苗管理法》规定的上市批准。
而目前在3-17岁人群的接种疫苗,是超过“说明书”接种范围的“紧急使用”(笔者下文详述)。
(二)上述疫苗针对3-17岁人群的“紧急使用”情况及法律瑕疵。
依据相关媒体、相关部门介绍,目前上述三款疫苗对3-17岁人群的使用属于“紧急使用”。
“紧急使用”是《疫苗管理法》规定的疫苗未经上市批准情况下紧急的使用方式。《疫苗管理法》第二十条第二款规定“出现特别重大突发公共卫生事件或者其他严重威胁公众健康的紧急事件,国务院卫生健康主管部门根据传染病预防、控制需要提出紧急使用疫苗的建议,经国务院药品监督管理部门组织论证同意后可以在一定范围和期限内紧急使用。”
然而,上述三款疫苗的所谓“紧急使用”比照《疫苗管理法》的规定存在诸多疑点和法律瑕疵。
第一,上述三款疫苗获得“紧急使用”的消息来源主要为疫苗生产厂家,未发现专业媒体有来源于国家机关方面针对具体厂家疫苗获批“紧急使用”的正式报道。
经笔者查询,针对国药北京生物疫苗,有媒体报导:“据中国生物官方微博消息,7月16日,经国务院联防联控机制有关部门组织论证,国药集团中国生物北京生物制品研究所(简称“国药集团中生北京所”)新冠病毒灭活疫苗获批在3-17岁人群中紧急使用。”所述“中国生物官方微博”就是国药集团的微博,所以该消息的准确严谨性存疑。
此外,笔者发现6月11日,人民日报报道“近期,我国有关部门已经批准了3—17岁人群的新冠病毒疫苗紧急使用。”但是需要注意的是,该报道并未描述批准“紧急使用”的行政机关具体是哪个部门,也没有描述疫苗的具体型号、生产单位。
第二,“国家药品监督管理局”未明确其系对上述疫苗“紧急使用”进行批准的行政机关,有可能不符合《疫苗管理法》的规定,存在法律瑕疵。
如前所述,疫苗管理法规定“经国务院药品监督管理部门组织论证同意后可以在一定范围和期限内紧急使用。”所述国务院药品监督管理部门即国家药品监督管理局。然而,从国药集团及其他媒体的报道,可知目前批准“紧急使用的”单位为“联防联控机制有关部门”,并未明确提及国家药品监督管理局。
笔者在国家药品监督管理局查询“紧急使用”的批准情况,没有查询到国家药品监督管理局对所述疫苗在我国3-17岁人群批准紧急使用的信息,也没有批准紧急使用的“一定范围”及“期限”信息。
上述情况说明,对所述疫苗批准紧急使用的单位,有可能并非法定的“国家药品监督管理局”,而是另有其他单位。而依据《疫苗管理法》规定,“紧急使用”应当经国家药品监督管理局组织论证同意。所以对所述疫苗在我国3-17岁人群紧急使用,进行批准同意的“单位”资格有可能不符合《疫苗管理法》的规定。笔者认为,可能因此原因,媒体对批准“紧急使用”的具体单位语焉不详。
第三,未发现国家药品监督管理局对所述疫苗在3-17岁人群紧急使用进行背书确认。
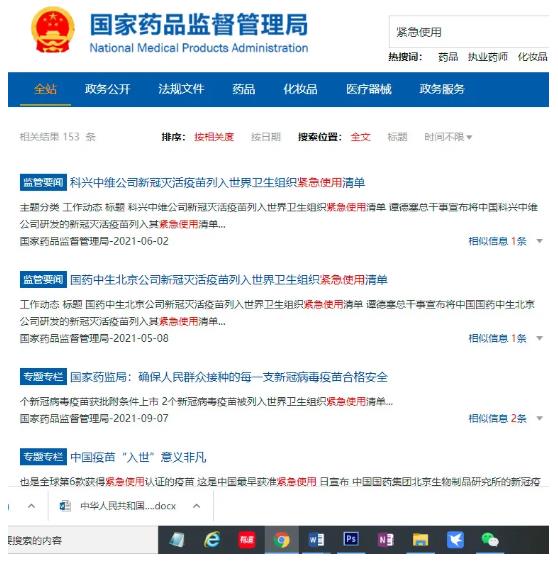
在2021年6月11日,7月16前后,有相当多媒体报道了我国新冠疫苗获批在我国3-17岁人群紧急使用。按常理,国家药品监督管理局作为药品管理监督部门,理应对上述新闻所涉信息进行公开、发文。然而经笔者在国家药品监督管理局查询,药监局在“信息公开”、“监管要闻”栏目均未查询到对国药、科兴在我国3-17岁人群紧急使用进行公开发文;而另一方面药监局却公开报道了“2021-05-08日,国药中生北京公司新冠灭活疫苗列入世界卫生组织紧急使用清单”,“2021-06-02日,科兴中维公司新冠灭活疫苗列入世界卫生组织紧急使用清单”两则信息公开、监管要闻信息。
国家药品监督管理局对世界卫生组织批准紧急使用我国疫苗进行公开,却对自己职责范围内我国3-17岁人群“紧急使用”疫苗只字不提,令人匪夷所思。笔者认为,该情况或正说明国家药品监督管理局对我国3-17岁人群“紧急使用”疫苗并未背书和确认。
第四、即便上述三款疫苗获批“紧急使用”,也应当考量其使用应符合“紧急使用”的条件。
依据《疫苗管理法》第二十条第二款规定,紧急使用的疫苗是应对“突发”、“紧急”“严重威胁公众健康”的事件。
然而,我国目前新冠疫情并不符合上述“紧急使用”的情形。其一,我国新冠疫情从2020年初开始出现,至今已经2年多时间,已经不属于“突发”“紧急”事件。其二,我国施行动态清零政策,感染人数极低。我国对新冠感染者、密切接触者、次密切接触者均施行隔离政策,故感染人数极低。通过动态清零政策,已经使得新冠对公众健康的威胁降低到较低水准。其三,即便感染新冠,重症比例也较低。按照我国公布的新冠感染者数据,新冠确诊病例中,大量为轻症病例、普通型病例,仅少数为重症病例,医疗部门积累的医疗经验,新冠导致死亡病例已极少。其四,目前所述疫苗未见显著防止传染的作用。通过我国近期新冠疫情发生的情况可知,在感染新冠者中接种疫苗的比例极高,该比例近乎等同于所有人群中接种疫苗的的比例,说明目前所述疫苗并无突出的防感染作用。综上所述,在3-17岁人群中要求全部接种疫苗并不符合“紧急使用”的情形。
第五,“紧急使用”的疫苗是一种非经过上市批准的疫苗,尚处于临床试验阶段,比上市疫苗更具有风险。
如前所述,所述疫苗在3-17岁人群中使用并未或上市批准。国药集团副总裁张云涛亦表述:“现在3-17岁只是紧急使用新冠疫苗,还没有批准附条件上市,后续我们会提供更多数据支持达到附条件上市的要求。”疫苗的批准上市是较为严谨地审核疫苗性能的程序,所述紧急使用疫苗尚处于临床阶段,未经上市批准,具有较高的风险。
(三)政府主管部门有责任对所述疫苗的接种采取“安全第一”的方针。家长对所述疫苗接种的拒绝具有相当强的合理性。
如前所述,所述疫苗获批在3-17岁人群可以使用是未经上市批准的“紧急使用”,较一般批准上市疫苗而言,存在较高的未知风险,而目前3-17岁人群并无需要“紧急”全部接种的必要性。
《疫苗管理法》规定“第三条 国家对疫苗实行最严格的管理制度,坚持安全第一”。故基于上述事实,政府主管部门有责任采取“安全第一”的方针,谨慎推行将所述疫苗在3-17岁人群接种;也基于上述事实,3-17岁学生家长对所述具有较高风险的疫苗选择不接种,且具有极强的合理性。
二、要求所有学生必须接种新冠疫苗,未接种疫苗学生每48小时进行一次新冠检测,是变相强制接种疫苗的违法行为,与法律规定的“自愿”接种相抵触。
(一)要求所有学生接种疫苗违反“自愿”接种疫苗的法律规定。
《疫苗管理法》规定:“本法所称疫苗….包括免疫规划疫苗和非免疫规划疫苗。”“非免疫规划疫苗,是指由居民自愿接种的其他疫苗。”目前,新冠疫苗不属于免疫规划疫苗。因此,居民接种新冠疫苗,应当是基于自愿,而非强制。
若教委或有关部门出台政策,要求所有学生必须接种新冠疫苗,直接违反《疫苗管理法》规定的自愿接种规定。
(二)要求未接种疫苗学生每48小时进行一次新冠检测,是变相强制接种疫苗非法行为。
第一,针对新冠检测,国家规定除“重点人群,应检尽检”外,均为“愿检尽检”,即自愿检测。联防联控机制综发﹝2020﹞181号《关于加快推进新冠病毒核酸检测的实施意见》规定:(一)重点人群“应检尽检”。1.密切接触者;2.境外入境人员;3.发热门诊患者;4.新住院患者及陪护人员;5.医疗机构工作人员;6.口岸检疫和边防检查人员;7.监所工作人员;8.社会福利养老机构工作人员。(二)其他人群“愿检尽检”。上述规定中,并未规定未接种疫苗人员必须进行新冠病毒核酸检测,因此3-17岁未接种疫苗学生属于“愿检尽检”范围。要求未接种疫苗学生每48小时进行一次新冠检测,直接违反上述规定。
第二,要求未接种疫苗学生每48小时检测核酸没有科学依据,其实施将导致学生家长不堪重负,被迫接种疫苗,构成变相强制接种行为。
其一,依据《关于加快推进新冠病毒核酸检测的实施意见》可知,要求进行核酸检测的是有可能接触外来新冠病毒的人员,如医疗机构工作人员、口岸检疫和边防检查人员等。而学生活动的主要路径是学校和家庭,并非容易接触新冠病毒的人群,故要求学生每48小时检查新冠,没有科学性。其二,学生每48小时检测一次核酸,必然增加学生在核酸检测点与其他重点检测人群的接触机会,反而导致学生容易感染。其三,每48小时检测一次核酸,其意味着家长、学生均须每两天请假一次进行核酸检测,无疑严重扰乱家长、学生的工作学习进程。因此,该政策将导致学生家长不堪重负,被迫接种疫苗,构成变相强制接种行为。
综上所述:所述疫苗在3-17岁人群接种为对非上市疫苗的“紧急使用”,具有一定的风险,政府主管部门有责任采取《疫苗管理法》要求的“安全第一”的方针,谨慎推行将所述疫苗在3-17岁人群的接种;3-17岁学生家长对所述具有较高风险的疫苗选择不接种,且具有极强的合理性;要求所有学生必须接种新冠疫苗,未接种疫苗学生每48小时进行一次新冠检测,是变相强制接种疫苗的违法行为,与法律规定的“自愿”接种相抵触,属违法行为。
希望北京市教委,北京市防疫主管机关充分考虑该项政策的合法性、合理性、适当性。
附件12020年12月30日国家药品监督管理附条件批准国药集团中国生物北京生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。https://www.nmpa.gov.cn/zhuanti/ypqxgg/gggzjzh/20201231193329157.html
附件2,国药北京生物新冠疫苗说明书,适用人群为18岁及以上。https://www.bjbpi.com/?p=75
附件3国家药品监督管理局官方网站,未查询到所述疫苗对3-17岁人群批准紧急使用的公开报道。仅有相关疫苗获世界卫生组织紧急使用信息。
https://www.nmpa.gov.cn/so/s?tab=all&qt=%E7%B4%A7%E6%80%A5%E4%BD%BF%E7%94%A8


 红歌会网 SZHGH.COM
红歌会网 SZHGH.COM


